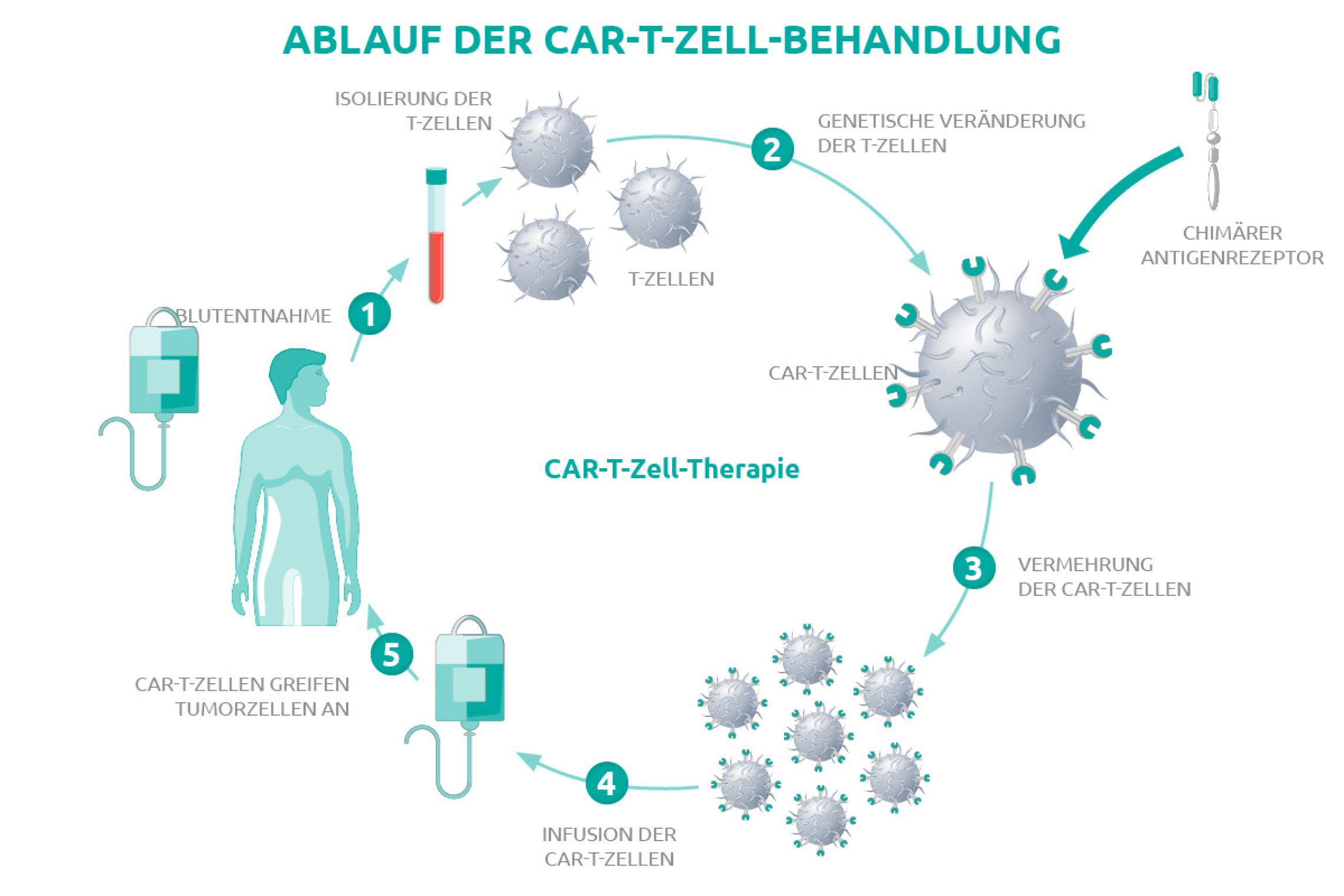
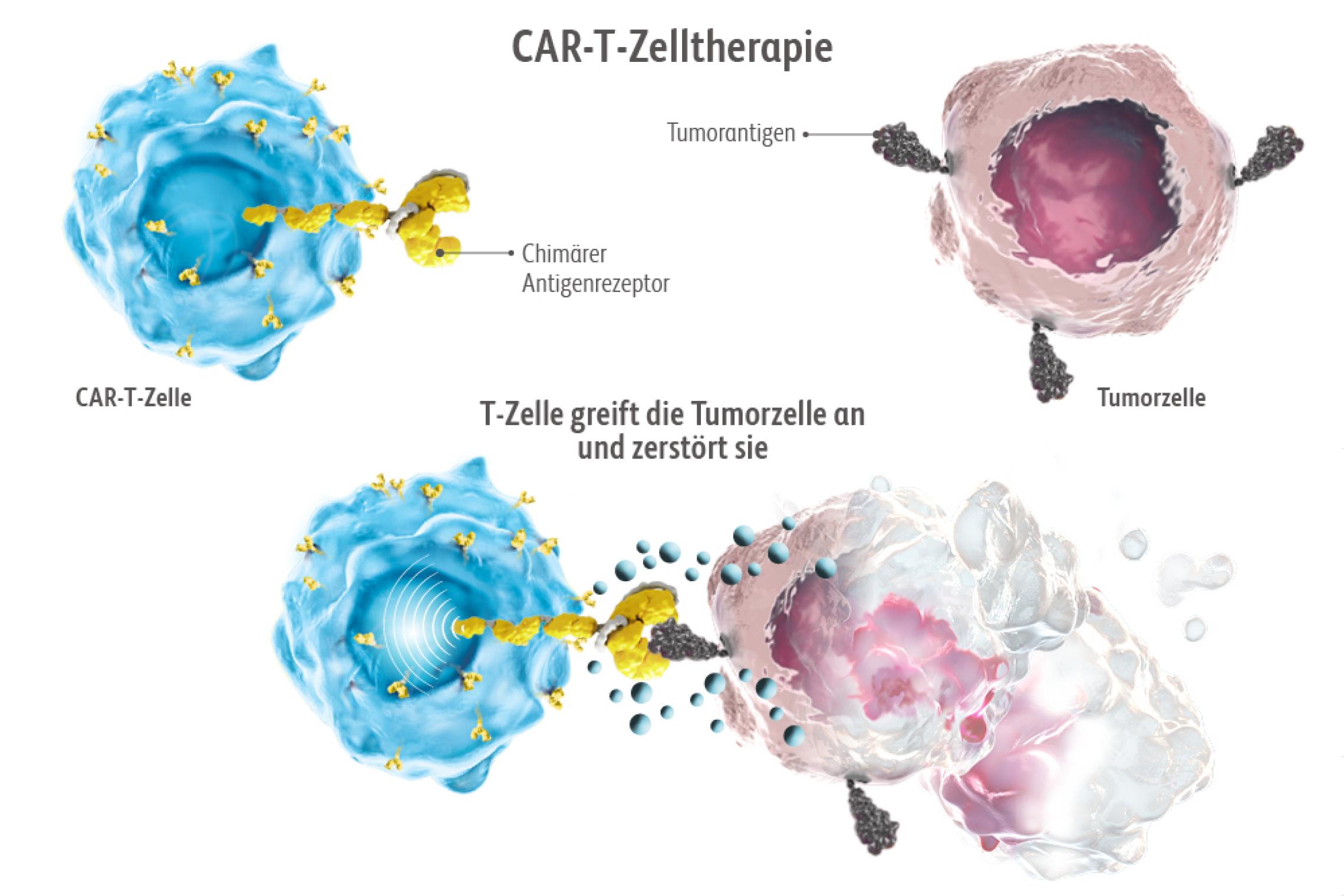
Wie andere Krebstherapien auch, können CAR-T-Zelltherapien Nebenwirkungen haben, die auch schwerwiegend sein können. Die besondere Wirkungsweise erfordert fundiertes Spezialwissen – zum einen für die schnelle Diagnose und zum anderen für die umgehende Behandlung. Deswegen dürfen CAR-T-Zelltherapien nur in entsprechend spezialisierten Zentren durchgeführt werden.
Eine sehr häufige Nebenwirkung ist das Zytokinfreisetzungssyndrom (cytokine release syndrome, CRS, Zytokinsturm). Es wird durch die Ausschüttung einer großen Menge von Zytokinen (Immun- und Entzündungsbotenstoffe) als Folge der Aktivierung unterschiedlicher Immunzellen durch CAR-T-Zellen verursacht. Eines dieser Zytokine ist beispielsweise das von Makrophagen bzw. Monozyten freigesetzte Interleukin-6 (IL-6). Das CRS geht unter anderem mit hohem Fieber, Müdigkeit, Übelkeit, niedrigem Blutdruck und Herz-Kreislauf-Störungen einher und tritt im Allgemeinen zwischen 1 und 10 Tagen nach Infusion der CAR-T-Zellen auf, meist zwischen 2 und 4 Tagen. In der Regel ist das CRS durch die Gabe eines therapeutischen Antikörpers zur Interleukin-6-Rezeptor-Blockade und mit Kortikosteroiden behandelbar. Es kann jedoch auch schwerwiegend und sogar in Einzelfällen tödlich verlaufen. Patient:innen mit einem CRS werden häufig auf der Intensivstation behandelt.
Auch neurologische Nebenwirkungen wurden beobachtet, u.a. Kopfschmerzen, Veränderungen des Gehirns, Delirium oder Verlust des Sprachvermögens. Auch ein verwaschenes Schriftbild kann frühzeitig in Erscheinung treten und damit zur Früherkennung einer Neurotoxizität herangezogen werden Häufig treten neurologische Nebenwirkungen während oder kurz nach überstandenem Zytokinfreisetzungssyndrom auf. Auch die neurologischen Nebenwirkungen können sich zu Notfallsituationen entwickeln und müssen umgehend behandelt werden. Die Ursachen der neurologischen Nebenwirkungen sind nicht vollständig geklärt und Gegenstand aktueller Forschung.
Zu den möglichen Nebenwirkungen der CAR-T-Zelltherapie gehört weiter das Tumorlysesyndrom, bei dem es durch die plötzliche Zerstörung von Tumorgewebe zur Ausschwemmung von Zellbestandteilen ins Blut kommt.
Da CAR-T-Zellen auch gesunde Immunzellen angreifen, die das entsprechende Antigen tragen, ist auch eine Immunsuppression mit einer vermehrten Infektionsneigung aufgrund eines Mangels an Immunzellen (Zytopenien) als Nebenwirkung möglich. Sind die B-Zellen betroffen, kann es zur verringerten Produktion von Antikörpern kommen.
Für Pflegekräfte, die Patient:innen mit einer CAR-T-Zell betreuen, ist es von eminenter Bedeutung, die Anzeichen für schwere Nebenwirkungen, insbesondere für ein Zytokinfreisetzungssyndrom, zu erkennen und unverzüglich und zu jeder Tages- oder Nachtzeit den behandelnden Arzt zu informieren, damit sofort eine Antikörpertherapie und eine Intensivbehandlung eingeleitet werden können.
Mehr erfahren Sie hier: www.bms-onkologie.de/car-t-zelltherapie