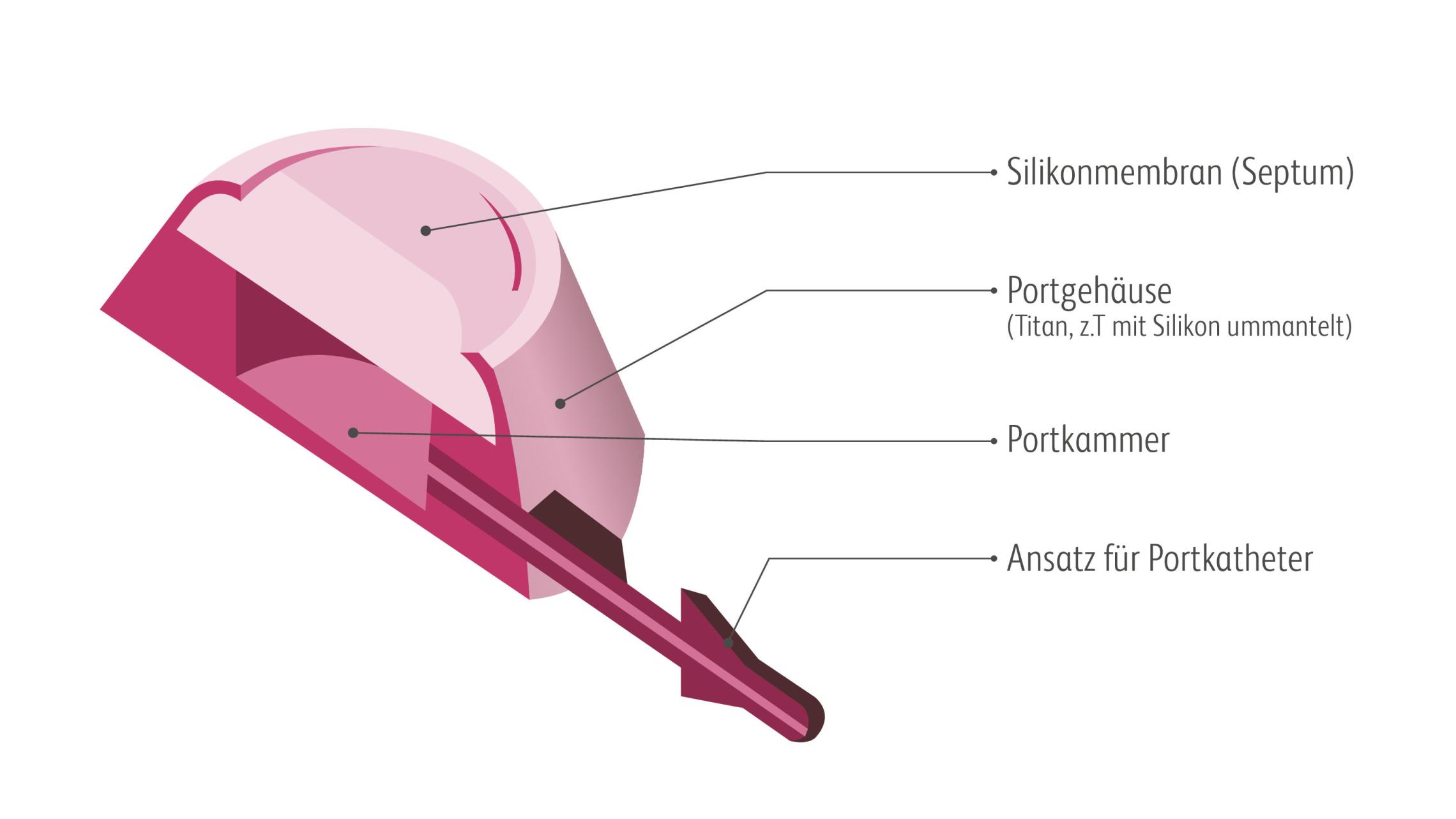
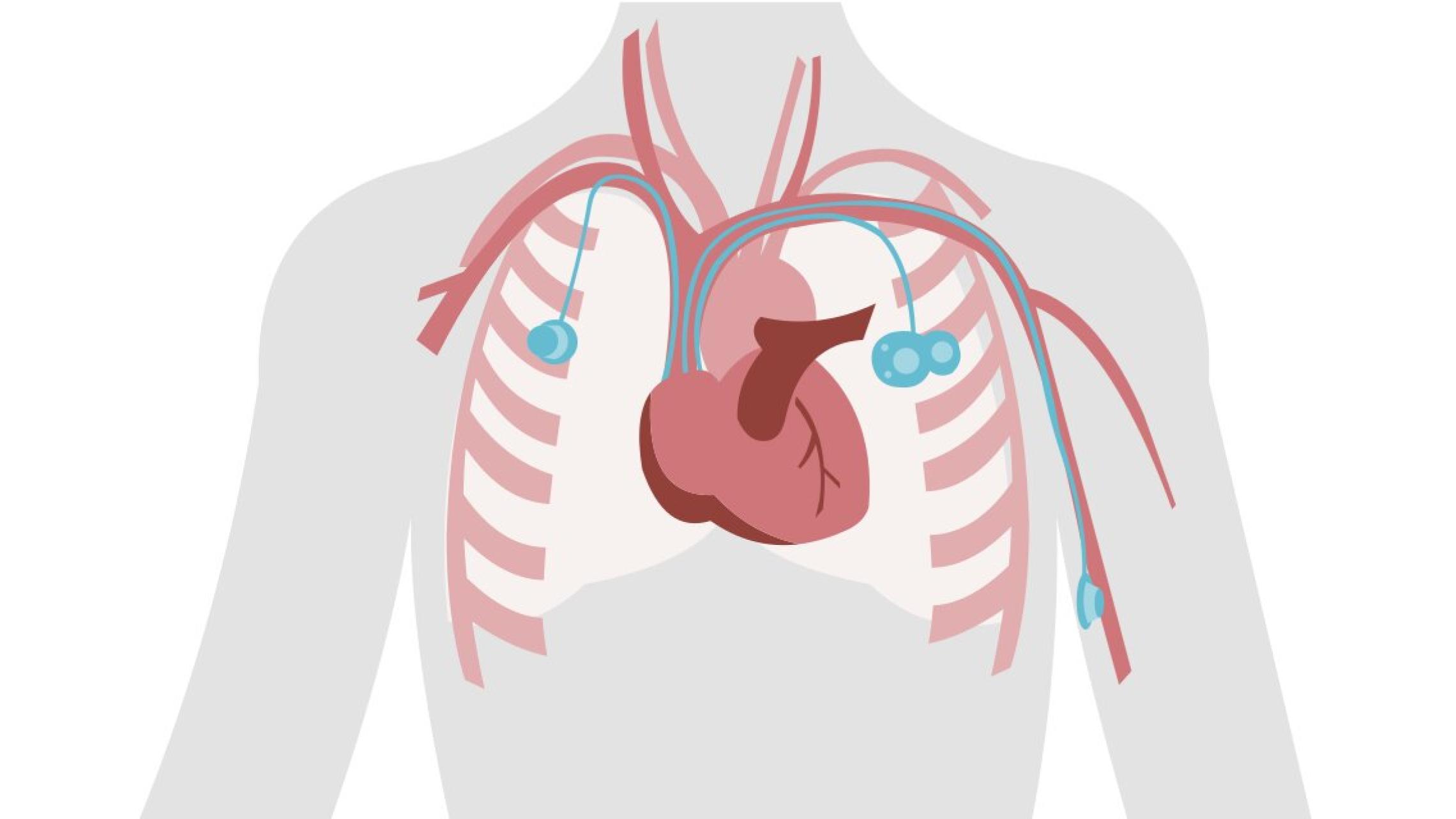
Es gibt mehr als 50 verschiedene Zytostatika als Medikamente für die Krebstherapie.
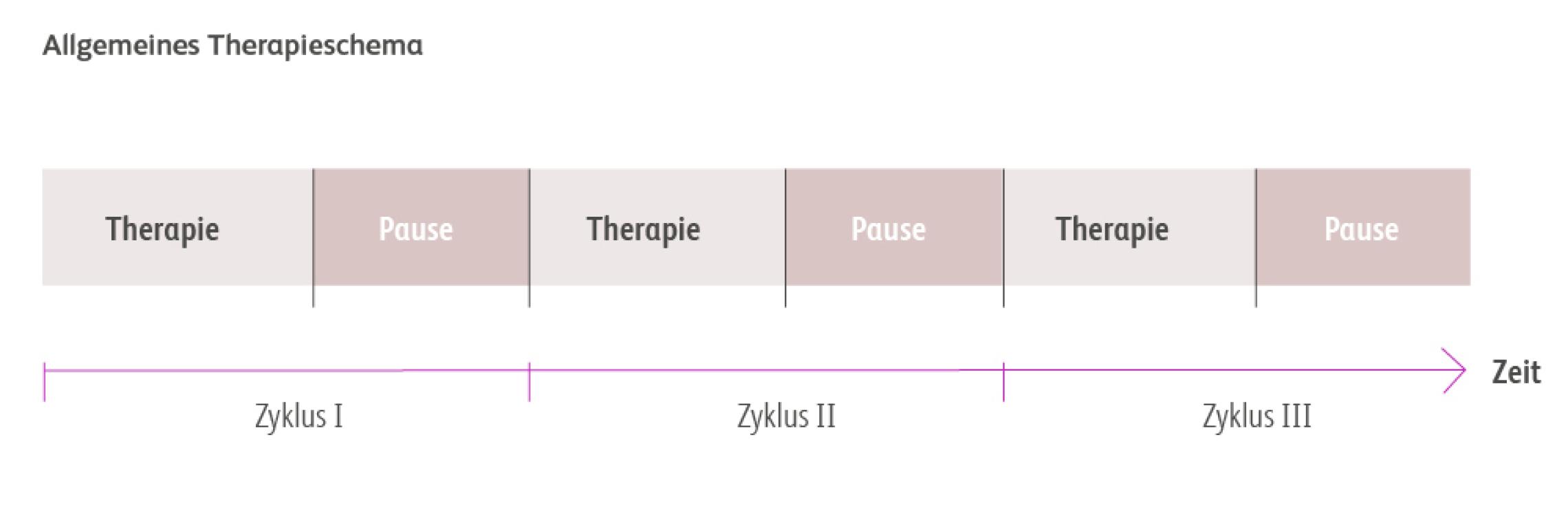
Die verschiedenen Wirkstoffklassen der Zytostatika wirken auf die Krebszellen in unterschiedlichen Phasen des Zellzyklus. Um so viele Krebszellen wie möglich in den unterschiedlichen Phasen zu erreichen, werden häufig mehrere Zytostatika miteinander kombiniert. Dies wird Kombinations-Chemotherapie oder Poly-Chemotherapie (griech. poly = viele) genannt.
Zu den wichtigsten Wirkstoffgruppen gehören:
Alkylantien
Alkylantien verbinden sich mit dem genetischen Material (DNS) des Zellkerns. Dessen Stränge werden dadurch entweder eng miteinander vernetzt oder brechen auseinander. Auf diese Weise wird die Weitergabe der Erbinformation bei der Zellteilung verhindert.
Beispiele für Alkylantien sind Cyclophosphamid sowie Platin-Derivate (Cisplatin, Carboplatin, Oxaliplatin).
Antimetabolite
Antimetabolite sind Gegenspieler körpereigener Stoffwechselbausteine. Solche Zytostatika werden bei der Teilung von Krebszellen anstelle der richtigen Bausteine in die DNS integriert. Dadurch werden an den betreffenden Stellen Abschnitte der Erbinformation zerstört.
Andere Antimetabolite ähneln wichtigen Substanzen, die ebenfalls beim Zellstoffwechsel eine Rolle spielen und blockieren so zum Beispiel für die Zellteilung wichtige Enzyme.
Beispiele für Antimetabolite sind
- Folsäure-Antagonisten wie Methotrexat (MTX)
- Purin-Analoga wie Fludarabin, Mercaptopurin
- Pyrimidin-Analoga wie 5-Fluorouracil (5-FU), Capecitabin, Gemcitabin
Zytostatisch wirkende Antibiotika
Im ursprünglichen Sinn sind Antibiotika Medikamente, die das Wachstum von Krankheitserregern hemmen oder diese abtöten. Einige Antibiotika können jedoch über ähnliche Wirkungsmechanismen auch Krebszellen zerstören.
Zu diesen Anti-Tumorantibiotika gehören die Anthracycline. Sie werden aus den Bakterien Streptomyces gewonnen und bewirken in den Krebszellen, dass die Erbsubstanz auseinander bricht und sich die Zellwand verändert. Anthracycline sind damit Zytostatika, die auch außerhalb der Zellteilungsphasen von Krebszellen wirken.
Vertreter der Anthracycline sind Doxorubicin und Epirubicin.
Mitosehemmer
Mitosehemmer bewirken eine Hemmung der Zellteilung über Blockade des sogenannten Spindelapparats der Zelle. Dieser ist für die korrekte Verteilung der Erbsubstanz auf die zwei Tochterzellen verantwortlich. Mitosehemmer werden daher auch "Spindelgifte" genannt. So geschädigte Tumorzellen können sich nicht mehr teilen und sterben ab.
Beispiele für Mitosehemmer sind
- Vinca-Alkaloide wie Vinblastin und Vincristin
- Taxane wie Paclitaxel und Docetaxel
Topoisomerase-Hemmer
Topoisomerase-Hemmer blockieren verschiedene Eiweißstoffe (Enzyme), die für die Reparatur von Brüchen im Erbmaterial verantwortlich sind. Damit werden körpereigene Reparaturmechanismen unterbrochen, die für sich schnell teilende Krebszellen wichtig sind. Alle Substanzen wurden ursprünglich aus giftigen Pflanzen entwickelt.
Beispiele für Topoisomerase-Hemmer sind Irinotecan und Etoposid.