Unter dem Begriff "Zielgerichtete Therapien" werden Medikamente zusammen gefasst, die sich gezielt gegen bestimmte biologische Merkmale des Tumors richten, die das Wachstum der Tumorzelle fördern. Häufig wird auch der englische Begriff "Targeted therapies" verwendet.Krebsinformationsdienst des Deutsches Krebsforschungszentrums Informationsblatt „Zielgerichtete Krebstherapien: Wie funktionieren sie?“ Stand Januar 2020 https://www.krebsinformationsdienst.de/service/iblatt/iblatt-zielgerichtete-krebstherapien.pdf?m=1581499697& Abruf 18.1.21 Krebsinformationsdienst Deutsches Krebsinformationszentrum (DKFZ) Zielgerichtete Krebstherapien: Targeted Therapies. Tumorwachstum blockieren, Stoffwechsel bremsen, Immunsystem aktivieren https://www.krebsinformationsdienst.de/behandlung/moderne-krebstherapien.php Abgerufen am 30.6.16
Zielgerichtete Therapien sind heute Bestandteil in der Behandlung verschiedener Tumorerkrankungen und können prinzipiell
- allein (Monotherapie)
- in Kombination mit einer Chemotherapie
- in Kombination mit einer Strahlentherapie
eingesetzt werden.
Diese Medikamente nützen jedoch nicht allen Patienten. Denn die jeweiligen Zielstrukturen, gegen die sie sich richten, müssen im Tumorgewebe tatsächlich vorhanden sein.Krebsinformationsdienst des Deutsches Krebsforschungszentrums Informationsblatt „Zielgerichtete Krebstherapien: Wie funktionieren sie?“ Stand Januar 2020 https://www.krebsinformationsdienst.de/service/iblatt/iblatt-zielgerichtete-krebstherapien.pdf?m=1581499697& Abruf 18.1.21 Deutsche Krebsgesellschaft (DKG) OnkoInternetportal Molekularbiologische Therapien. https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/therapieformen/molekularbiologische-therapie.html Abgerufen am 30.6.16
Daher werden zuvor mit speziellen Tests die biologischen Merkmale des Tumors bestimmt. Damit lässt sich herausfinden, ob der Patient von einer zielgerichteten Therapie profitieren kann.Krebsinformationsdienst des Deutsches Krebsforschungszentrums Informationsblatt „Zielgerichtete Krebstherapien: Wie funktionieren sie?“ Stand Januar 2020 https://www.krebsinformationsdienst.de/service/iblatt/iblatt-zielgerichtete-krebstherapien.pdf?m=1581499697& Abruf 18.1.21
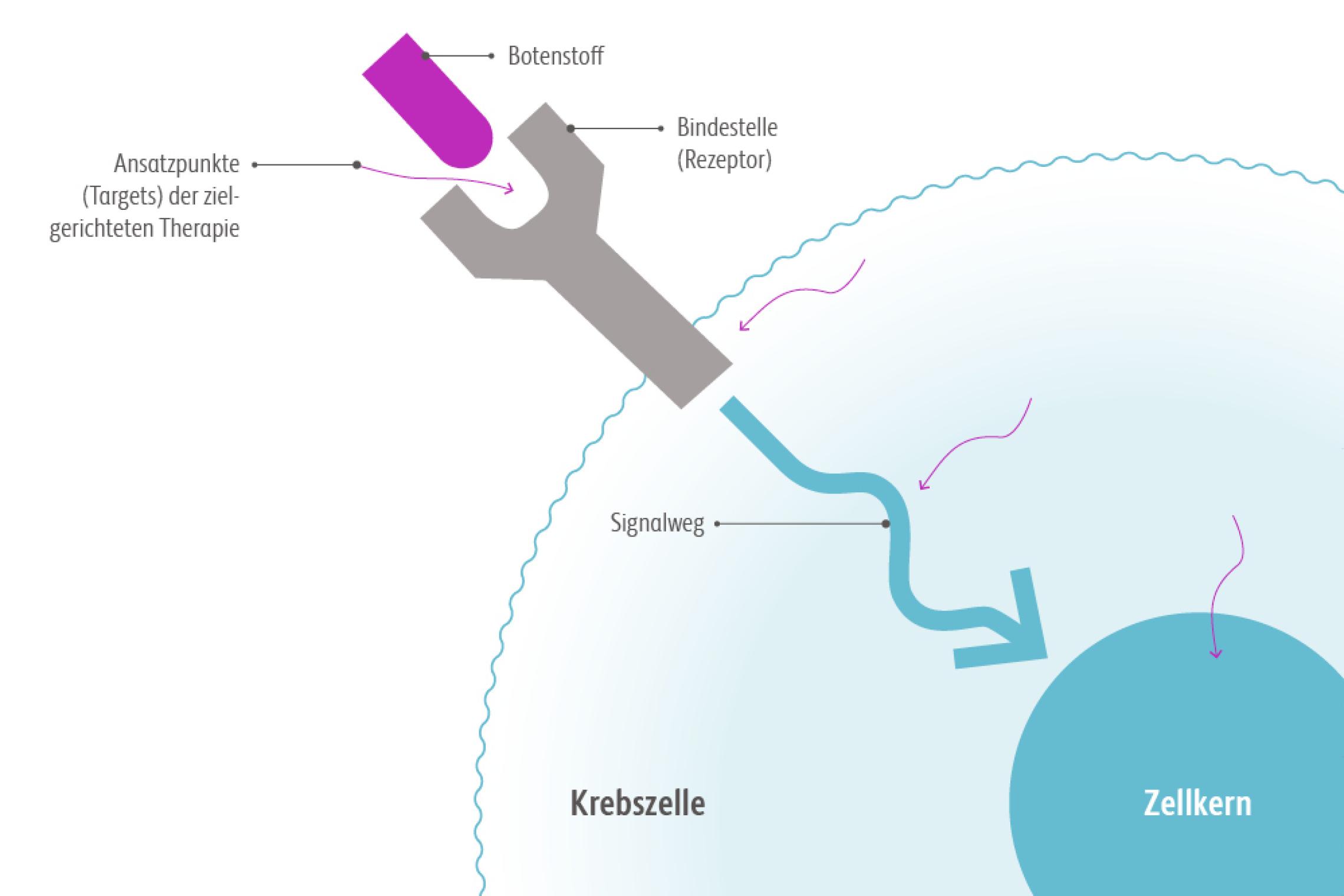
Zielgerichtete Medikamente wirken, indem sie sich gegen bestimmte Zielstrukturen der Tumorzelle richten, die für deren Wachstum wichtig sind.Krebsinformationsdienst Deutsches Krebsinformationszentrum (DKFZ) Immuntherapien bei Krebs. Monoklonale Antikörper: Wichtig in Diagnostik und Therapie. https://www.krebsinformationsdienst.de/behandlung/monoklonale-antikoerper.php Abgerufen am 30.6.16 Dazu gehören:
- Rezeptoren auf der Zelloberfläche
- Botenstoffe, die am Rezeptor anbinden
- Signalwege im Zellinnern (intrazellulär)
Damit können die folgenden Parameter beeinflusst werden:Krebsinformationsdienst des Deutsches Krebsforschungszentrums Informationsblatt „Zielgerichtete Krebstherapien: Wie funktionieren sie?“ Stand Januar 2020 https://www.krebsinformationsdienst.de/service/iblatt/iblatt-zielgerichtete-krebstherapien.pdf?m=1581499697& Abruf 18.1.21 Krebsinformationsdienst Deutsches Krebsinformationszentrum (DKFZ) Zielgerichtete Krebstherapien: Targeted Therapies. Tumorwachstum blockieren, Stoffwechsel bremsen, Immunsystem aktivieren https://www.krebsinformationsdienst.de/behandlung/moderne-krebstherapien.php Abgerufen am 30.6.16 Deutsche Krebsgesellschaft (DKG) OnkoInternetportal Molekularbiologische Therapien. https://www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/therapieformen/molekularbiologische-therapie.html Abgerufen am 30.6.16
Eingesetzte Medikamente sind vor allem monoklonale Antikörper und Tyrosinkinase-Hemmer.